每经数说丨10月上半月新药研发:信达生物利妥昔获批上市,康方生物AK104纳入突破性疗法程序
每经记者 金喆 每经编辑 梁枭

丁香园Insight数据库援引国家药品监督管理局药品审评中心数据显示,9月16日~10月15日,中心共承办952例申报进度,其中受理化药申请734项,抗体类80项,多肽35项,中药申请32项,非抗体类蛋白29项,疫苗类17项,血液制品相关12项,辅料3项,细胞治疗2项,微生物相关1项。
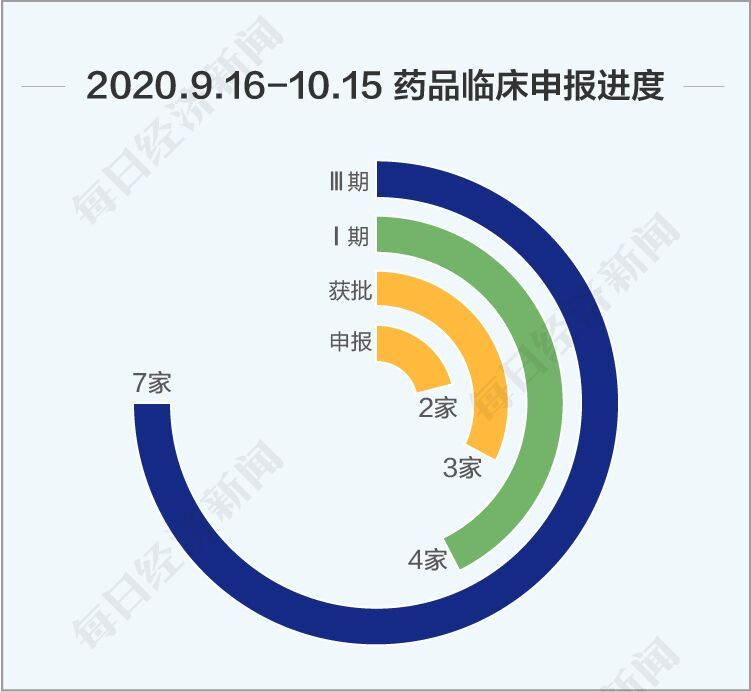
回顾9月16日以来的一个月,一类新药申报数量再创新高,本阶段一类新药临床申请数量达到55个,上市申请6个,抗肿瘤药物仍是主要研发方向。《每日经济新闻》记者认为,本阶段新药研发的亮点如下:
一、信达生物生物类似药利妥昔单抗注射液获批上市;
二、康方生物PD-1/CTLA-4双抗AK104纳入突破性疗法程序;
创新药研发势头猛烈,投资市场也一片红火。本阶段,再鼎医药在香港上市,成为首个在香港二次上市的医药企业,目前市值超过500亿港元。此外,高瓴资本投资的嘉和生物也在10月7日在港交所挂牌上市,此前认购倍数达到1247倍。
每月要闻
(1)信达生物生物类似药利妥昔单抗注射液获批上市,为国内第二家
每经点评:国产第二家,利妥昔又要降价了吗?
利妥昔单抗,是目前临床使用较广泛的单克隆抗体药物,原研药美罗华1997年11月在美国上市。2000年4月,美罗华在中国上市,并在2017年进入国家医保目录,500mg/50ml/瓶的规格降到8298元,100mg/10ml/瓶规格降到2418元。
《每日经济新闻》记者注意到,目前美罗华在中国获批的适应症如下:慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、滤泡性淋巴瘤、CD20阳性弥漫性大B细胞淋巴瘤、CD20阳性晚期/转移性滤泡性淋巴瘤、滤泡性中央型淋巴瘤。
2019年2月22日,复宏汉霖的利妥昔单抗注射液(商品名为汉利康)获批上市,成为国内获批的首个生物类似药,目前获批的适应症包括:慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、滤泡性淋巴瘤、CD20阳性弥漫性大B细胞淋巴瘤、CD20阳性晚期/转移性滤泡性淋巴瘤、滤泡性中央型淋巴瘤。
汉利康于2019年在多地被纳入医保,Insight数据库显示,其目前最低中标价为1398.00元(100mg/10ml/瓶)。
信达生物本次获批上市的利妥昔单抗达伯华共包含3个适应症,分别是弥漫性大B细胞淋巴瘤、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤和滤泡性淋巴瘤。
也就是说,达伯华目前适应症比汉利康少2个。如果是价格战,汉利康的价格已经比美罗华便宜42%,失去首发优势的信达生物又要如何搅局呢?
信达生物内部人士接受媒体采访时说:“我们相信目前市场规模足够大且在不断增长,也存在巨大的未被满足的临床需求。我们希望我们能够为需要的老百姓提供可负担、高质量的利妥昔单抗。”
与其他热门药物一样,国内还有多家企业在利妥昔的研发路上。Insight数据库显示,海正药业、正大天晴、嘉和生物、华兰生物、山东新时代、上海生物制品研究所、喜康(武汉)生物医药有限公司等7家企业的利妥昔单抗处于三期临床,还有4家公司处于一期临床、3家公司获批临床、2家公司申报临床申请。
复宏汉霖的汉利康上市给原研药带来的压力已经显现。我们可以预见,未来利妥昔的竞争将相当激烈。不过,达伯华获批上市的消息还是在二级市场有所反应。10月12日,信达生物涨幅超过10%,10月15日盘中股价触及上市以来新高69.75港元/股。
(2)康方生物PD-1/CTLA-4双抗AK104纳入突破性疗法程序
每经点评:康方生物王牌产品研发又进一步,国内双抗药物成色如何?
10月12日,康方生物公布,其核心自主研发的、全球首创的新型肿瘤免疫治疗双特异性抗体新药PD-1╱CTLA-4(研发代号:AK104),获国家药品监督管理局药品审评中心审核同意,纳入“突破性治疗药物品种”。
近年来,双抗巨大的治疗潜力,正促使双抗药物成为新药研发投资的“新宠”。据弗若斯特沙利文预测,到2025年,双抗研发管线的增长速度可以达到常规单抗药物的3倍,且随着全新双抗进入市场,同时已上市双抗获批更多适应症,市场规模将达到80亿美元(约合人民币560亿元)。
而在国内,双抗药物的研发属于稀缺品种,而且全部集中在肿瘤治疗领域。信达生物新药生物与转化医学副总裁徐伟博士此前对科技日报记者谈到,肿瘤治疗已从最初的化疗、靶向治疗过渡到了免疫治疗,极大提高了病人的生存率。
在这条竞争白热化的赛道上,平台与靶点选择的适配性,是当下决定双抗项目能否成功的关键因素。因为一个适应双抗分子的技术平台,对分子的成药性、错配率和稳定性有重要影响。《每日经济新闻》记者注意到,目前国内双抗药物研发主要围绕PD-1、HER2的靶点。
根据丁香园Insight数据库,国内在研双抗药物中,PD-1/PD-L1是主流靶点,不计引进项目就有14个PD-1/PD-L1国产双抗品种在研;其次热门的双抗靶点还包括CD3、CTLA4、HER2等。
AK104之所以受市场看好,主要有两方面原因:一是全球首个进入临床试验的PD-1/CTLA-4双特异抗体,二是覆盖多癌种。
Insight数据库显示,该药已在CDE登记并启动6项临床,在ClinicalTrails.gov登记11项临床,单药或联合用药治疗多种实体瘤。其适应症布局包括肝细胞癌、鼻咽癌、非小细胞肺癌、胃癌、三阴乳腺癌等多个癌种,国内最高处于二期临床。
目前,国内同靶点双抗仅齐鲁QL1706,于2020年3月启动一期临床。另外,已进入临床阶段的靶向CTLA-4双抗还包括康宁杰瑞KN046(PD-L1/CTLA-4)和四川百利SI-B003(PD-1或L1/CTLA-4),分别处于三期临床和二期临床。
每月数读
(1)本阶段首次注册上市的品种有11个,在注册品种36个。按类别划分(合并不同规格统一品种),化药仿制药32个,生物制品类似药1个,非原研/类似药生物制品1个。
本阶段申报的项目中,化药仿制药272项,化药新药/原研药271项,生物制品新药/原研药104项,化药改良型新药13项,非原研/类似药生物制品10项,生物制品改良型新药6项,生物制品类似药6项,暂时不明29项。
按成分治疗领域排名,前五位是:抗肿瘤药物(151项),抗感染药物(109项),内分泌系统和代谢药物(81项),心血管系统药物(74项),神经系统药物(74项)。
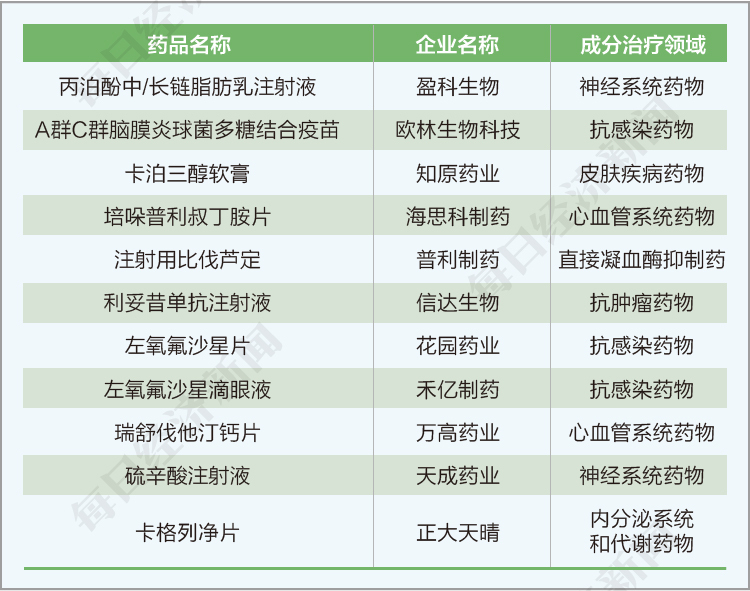
(2)本阶段申报的项目中,化药仿制药272项,化药新药/原研药271项,生物制品新药/原研药104项,化药改良型新药13项,非原研/类似药生物制品10项,生物制品改良型新药6项,生物制品类似药6项,暂时不明29项。
按成分治疗领域排名,前五位分别是:抗肿瘤药物(151项),抗感染药物(109项),内分泌系统和代谢药物(81项),心血管系统药物(74项),神经系统药物(74项)。
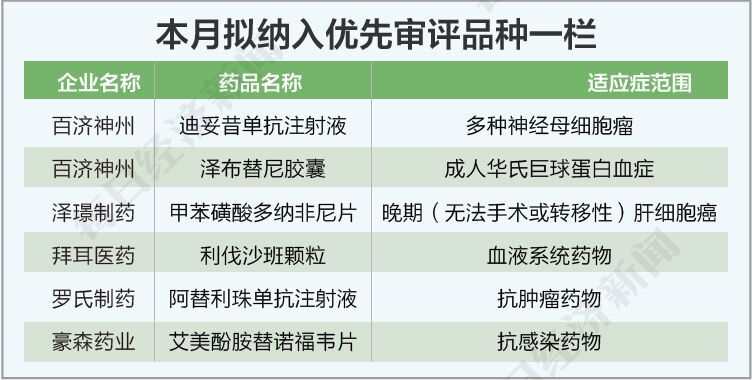
本月纳入优先审评的品种有6个。
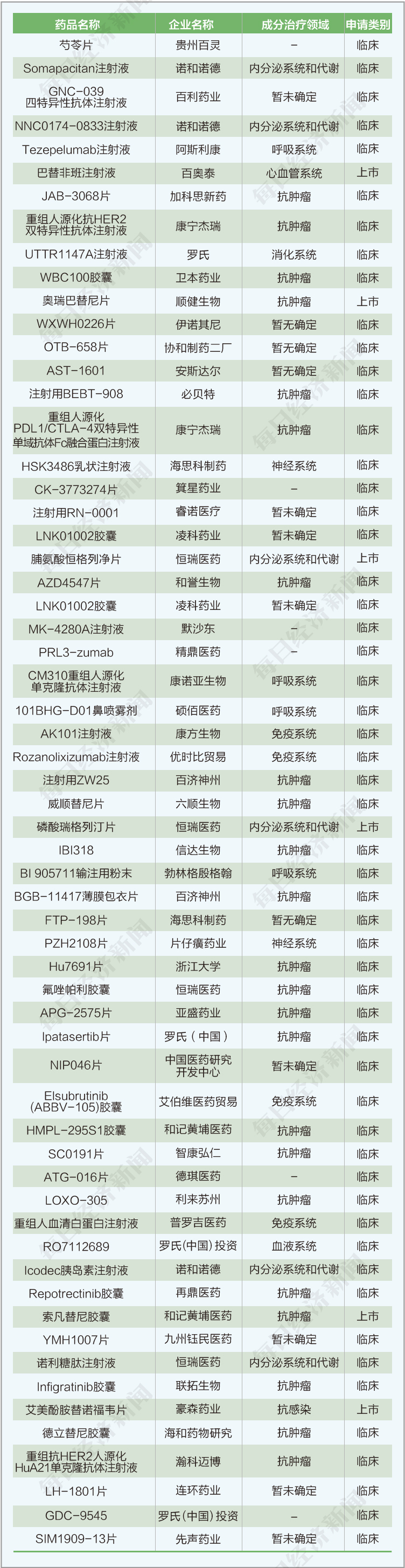
(3)本期共有一类注册新药临床申请55个,上市申请6个。
 每经头条
每经头条
 每经热评
每经热评















 川公网安备 51019002002025号
川公网安备 51019002002025号






