美国临床再加速!中国人工心脏“头对头”试验安全性阶段完成,FDA放行大规模确证性研究
中国人工心脏企业“出海”有重要进展——当地时间8月6日,同心医疗美国全资子公司BrioHealth Solutions宣布,顺利完成其与雅培全磁悬浮人工心脏“头对头”INNOVATE美国临床试验的安全性阶段(Safety Phase),并获得美国食品药品监督管理局(FDA)批准进入确证性临床阶段(Pivotal Phase)。由此,同心医疗自主研发产品BrioVAD正式拿到在美国确证性大规模临床的“通行证”——进入确证性阶段后,INNOVATE临床试验的合作研究中心扩展到60家,并可累计入组780名受试者。
人工心脏学名心室辅助装置(VAD),是一类高度复杂的有源植入式医疗器械,用于晚期心力衰竭患者提供血流动力学支持,其技术壁垒、临床风险、监管门槛堪称全球医疗器械之最,被称为“医疗器械皇冠上的宝石”。2024年,全球首项针对两款全磁悬浮人工心脏的多中心头对头大型研究INNOVATE临床试验由中国企业同心医疗发起——同心医疗的BrioVAD向雅培公司的产品HeartMate 3发起挑战。HeartMate 3于2017年获批上市,全球累计植入量超过4万例,目前是人工心脏市场当之无愧的“霸主”。
在美国,高风险植入设备如人工心脏类必须通过IDE临床通道逐步推进,通常包括安全性阶段(Safety Phase)和确证性阶段(Pivotal Phase),最终以PMA(Pre-Market Approval)注册上市,这一程序也是美国医疗器械上市申报方式中最为严苛的制度。能否获得FDA批准进入Pivotal阶段,往往被视为判断一款产品是否具备全球领先技术水准的标志性节点。
BrioVAD此次获批进入Pivotal阶段,验证了其在初步人体试验中的安全性和临床可行性。更为重要的是,Pivotal阶段是注册上市前的核心数据来源,需大规模、多中心、对照设计,可直接支撑PMA申请。这一里程碑标志着中国原创的高风险有源植入式医疗器械,第一次在美国临床监管框架中穿越了“安全性验证”与“有效性确证”之间的关键门槛,“中国创造”开始争夺全球高端医疗器械的话语权。全球心血管领域的临床专家也期待,这场“顶级对战”,能够推动全球人工心脏行业的进一步发展。
“弯道超车”的中国人工心脏
心力衰竭作为全球医学领域的重大挑战,被称为“心脏病中的癌症”——据世界卫生组织统计,全球心力衰竭患者超6000万,终末期患者数量约320万。中国35岁及以上心衰患者达1370万,终末期心衰患者约100万。心衰一经确诊,5年死亡率达50%,与恶性肿瘤生存率相当。对于晚期心力衰竭患者,心脏移植和植入式心室辅助装置(简称“VAD”,俗称“人工心脏”)治疗是仅有的有效延长患者生命的手段。但心脏移植供体有限。从2012年到2022年,10余年间,全球年心脏移植数量仅从5935例增长至8988例。
在供体(可移植心脏)严重不足的情况下,“人工心脏”植入成为当前大规模治疗心衰的唯一手段。从人工心脏的技术代际来看,根据植入5年后的随访数据,HeartMate 3全磁悬浮技术的LVAD的生存率达到65%左右,几乎跟心脏移植的存活率相当,远高于机械轴承产品及磁液混合悬浮不到50%的生存率,因此也是目前最先进的人工心脏技术。
中国的人工心脏起步虽晚,但发展迅速。近年来,在创新医疗器械特别审批、国产替代优先采购、医保支付试点及科研资金扶持等政策层面的全力支持下,国内人工心脏领域迈入发展快车道,目前共有5家企业(4家国产、1家外资)6款产品获批。其中,同心医疗CH-VAD植入式左心室辅助系统于2021年正式上市,成为我国首个获批上市的全磁悬浮人工心脏。
中国工程院院士、中国医学科学院阜外医院院长胡盛寿团队成员王现强主任医师今年5月提到,截至2024年底,全国推广应用医院超100家,培养人工心脏技术人才600余人,目前累计在全国20多个省份的190多家医院完成超过1500例植入,建立了人工心脏治疗重症心衰的多学科协同诊疗模式,显著提高了我国危重症心衰的救治水平。
全磁悬浮人工心脏全球首个大规模“头对头”研究
人工心脏作为直接与血液接触的植入型医疗器械,如何减少机械摩擦、保证血液成分在血泵内部流经的时候不被破坏,进而减少泵内血栓、中风和出血事件等不良反应的发生概率,是提高患者生存率的重要保障。
在数次技术迭代后,HeartMate 3引领的全磁悬浮技术脱颖而出,它使核心部件转子在血液中完全悬浮起来,避免摩擦和挤压血液带来的血细胞损伤。
相比之下,同心医疗CH-VAD的技术则进一步“进化”:采用自主创新的“分立式磁悬浮结构”,血泵转子更大,可用一半的转速产生相同的流量,转动时稳定性高,对血液的破坏更小;优化的流体力学设计让血液更“畅快”、更平滑地流动,减少血细胞、血小板等物质流动时的破坏。而且,血泵体积较HeartMate 3更小、更轻,经皮电缆也是目前全球最细的,对患者的手术创伤更小,并有利于长期抗感染。
2021年CH-VAD在中国获批上市后,胡盛寿团队持续进行了多年随访研究,相关结果在国际心胸外科顶尖期刊发表,赢得海内外高度关注。近两年来,中国学者在多个国际顶级学术舞台和顶级学术杂志发布CH-VAD的真实世界研究结果,让全球人工心脏领域的专家都看到了中国创造的崛起。
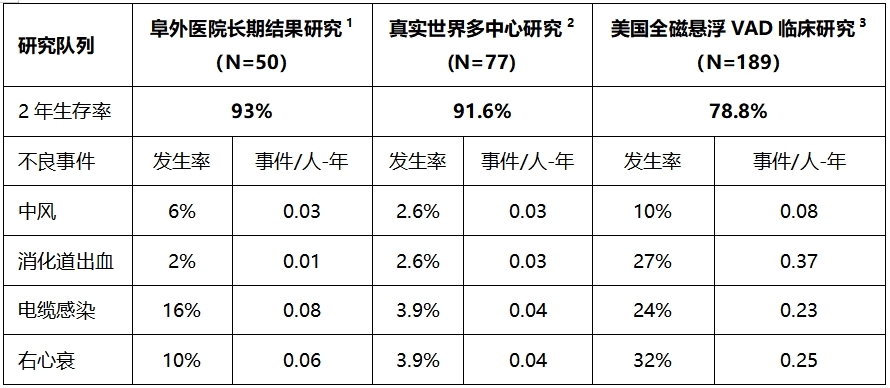
1.Wang et al.JHLT,Vol 43,No 11,Nov.2024;
2.Lu et al.iScience.2025 Jan 7;28(2):111764;
3.https://www.accessdata.fda.gov/cdrh_docs/pdf16/P160054B.pdf
2024年,同心医疗正式发起INNOVATE临床试验,这项前瞻性、非盲、随机、对照、多中心、确证性研究,设定参与者以2:1的比例随机接受BrioVAD或HeartMate 3植入,主要终点指标是短期(6个月)和长期(24个月)免于致残性卒中和泵置换的生存率。其他终点指标包括评估心力衰竭患者的不良事件、心功能和生活质量。研究还将验证植入BrioVAD是否能减少随访期内的总住院天数。
值得一提的是,BrioVAD不仅是中国首个获得FDA批准并正式进入临床试验的原创有源植入式医疗器械,还是首个获得美国医保覆盖的国产植入式医疗器械,每例临床可报销22万美元。
在此以前,尽管“中国制造”医疗设备“出海”多年,但出口产品结构仍以低值耗材及普通设备为主,真正通过国际权威机构临床验证,尤其是做“头对头”对比试验的高端器械极为罕见。BrioVAD的多番“破冰”,不仅代表着国际领域对中国原研高端医疗器械临床价值的认可,更是对中国制造标准的国际性认证。
抱着对同心医疗的极大期待,全美几乎所有领先的人工心脏中心和专家,均已官宣参与或正在加入临床试验。此次安全性阶段试验的完成,更成为同心医疗美国临床的重要加速器。
“随着安全性阶段试验的圆满完成,我们非常激动推进INNOVATE试验的关键性阶段。我们的目标始终是为临床医生提供更多治疗终末期心衰的选择,造福当前受此疾病困扰的患者。”密歇根大学Otto Gago心脏外科教授、该研究全国首席研究员Francis D.Pagani博士表示。
美国植入人工心脏的患者中,全磁悬浮人工心脏使用比例已接近100%。但对于心脏专家来说,他们认为“当前美国市场上只有一种装置可用,这对患者来说很不理想。如果出现故障或供应链问题,患者将别无选择。在这种情况下,为我们的患者提供其他选择至关重要。”
从无到有、从弯道超车到挑战“全球霸主”,以BrioVAD为代表的中国人工心脏不仅致力于为全球心衰患者提供更优治疗选择,更以“中国方案”推动高端医疗器械的技术范式革新。随着试验数据的逐步公布,中国人工心脏有望改写国际临床指南,重塑全球市场格局。
 每经头条
每经头条
 每经热评
每经热评














 川公网安备 51019002002025号
川公网安备 51019002002025号






